HPVワクチンについて
HPVワクチンって?
子宮頸がんは、性交渉によるヒトパピローマウィルス(HPV)の感染によって発症します。
現在、HPVワクチンが開発され、世界中で接種されていますが、日本ではほとんど接種されていません。
このページではHPVワクチンの有効性や副作用などの安全性について解説します。
1.日本で接種できるワクチンの種類と接種方法、接種対象者は?
現在、日本で接種できるワクチンはガーダシルとサーバリックスの2種類となります。それぞれの特徴を見てみましょう。
| ガーダシル(4価ワクチン) | サーバリックス(2価ワクチン) | |
|---|---|---|
| 予防できる型 | HPV6/11/16/18型 | HPV16/18型 |
| 接種回数 | 3回 | 3回 |
| 接種間隔 | 0、2ヶ月後、6ヶ月後 | 0、1ヶ月後、6ヶ月後 |
| 接種方法 | 筋肉注射 | |
| 費用無料の対象 | 小学校6年生から高校1年生相当(12-16歳)の女子は無料 | |
| 定期接種対象者以外の人の費用 | 病院によって誤差あるが1回16,000-18,000円くらい。3回接種なので、トータル費用は5万円程度。 | |
日本ではどちらのHPVワクチンも、小学校6年生から高校1年生相当(12-16歳)の女子は無料で受けられます。
なぜ小学校6年生から高校1年生相当(12-16歳)の女子は無料なのかというと、HPVは性交渉で感染するため、性交渉未経験と考えられる時期にワクチンを打つのが最も効果的だからです。
ただし、性交渉経験後であったとしても、HPV16/18型にかかっていない場合があり、ワクチンの効果があると言われています。
これまでの研究から、45歳までの年齢でワクチンの有効性が証明されています1,2)。
ガーダシルやサーバリックスを接種すれば、子宮頸がんの原因の70%を占めるHPV16/18型の感染予防ができます。
しかし、逆に言えば子宮頸がんは30%がHPV16/18型以外のHPV型感染によって起こっているということであり、検診もしっかり受けて子宮頸がんの早期発見に努める必要はあります。
最近では、米国で9つのHPV型(6,11,16,18,31,33,45,52,58型)を防ぐ9価ワクチンが開発され発売されました。
現在日本で発売されている、ガーダシル(4価ワクチン)、サーバリックス(2価ワクチン)よりも、多くのHPV型感染を防ぐことができます。
9価ワクチン接種によって子宮頸がんの90%以上が予防可能になると期待されています3)。
2.HPVワクチンを接種している海外のデータからみる、HPVワクチンの有効性
海外では2006-2008年より各国でHPVワクチンの接種が開始となりました。オーストラリア、アメリカでは男子へのワクチン接種も開始されました。
オーストラリア、イギリス、アメリカ、北欧などの国々では、HPVワクチンを接種した世代のHPV16/18型感染が劇的に減少しています4-7)。
そして、HPV16/18型感染の減少により、子宮頸がんの前癌病変である高度異形成になる人数も減少傾向というデータが揃ってきました。
例えば、オーストラリアでHPVワクチン接種開始後、子宮頸がんの前癌病変である高度異形成(CIN2/3)となる女性が減ったという報告があります8)。
アメリカでも同じように、HPVワクチン接種世代の前癌病変発生率が減っています9)。
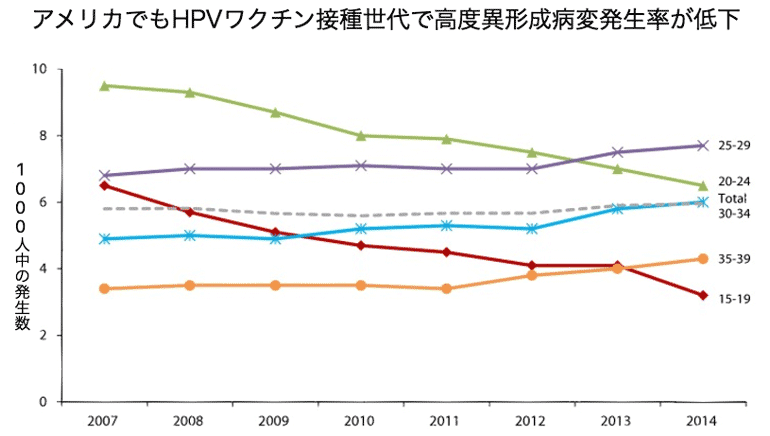
スコットランドやスウェーデンからも、HPVワクチン接種世代で、前癌病変の発生率が減少したという報告があり10,11)、HPVワクチン接種による子宮頸がんの前癌病変予防の効果が科学的に実証され始めました。
さらには、前癌病変だけではなく、子宮頸がんそのものも減少したとされる報告も出始めています12)。
今後は、HPV感染や前癌病変の発生率の減少報告だけではなく、子宮頸がん自体が減少したとする報告が、海外から次々と発信されてくると予想されます。
3.日本でのHPVワクチン接種中止の経緯
それでは、これだけ子宮頸がんを防ぐ可能性があるワクチンが、なぜ日本だけ接種されていないのでしょうか。
実は日本でもHPVワクチンが接種開始となっていましたが、定期接種開始から、わずか3ヶ月で接種中止に追い込まれてしまいました。
ここでは、日本におけるHPVワクチンについての経緯を説明します。
| 2009年10月 | 2価ワクチン(サーバリックス)が日本で承認 |
|---|---|
| 2010年11月 | HPVワクチンの公費助成が開始 |
| 2011年7月 | 4価ワクチン(ガーダシル)が日本で承認 |
| 2013年4月1日 | 予防接種法の一部改正→HPVワクチン定期接種開始 |
| 2013年6月14日 | ワクチンの副反応の報告を受け、厚生労働省は積極的な接種勧奨の一時差し控えを決定。 |
| 2014年1月20日 | ワクチン接種副反応として報告された症例について審議。広範な疼痛・運動障害のメカニズムとして、心身の反応によるものが示唆。 |
| 2015年9月17日 | 副反応追跡調査結果の報告を受け、現時点では積極的勧奨の一時差し控えは継続することが適当と判断。 |
| 2016年7月27日 | 全国子宮頸がんワクチン被害者連絡会が集団訴訟に踏み切る。 |
| 2016年12月26日 | 全国疫学調査(祖父江班)の結果報告 |
世界各国でHPVワクチンが接種され、日本でも2010年にHPVワクチンの公費助成が開始となりました。
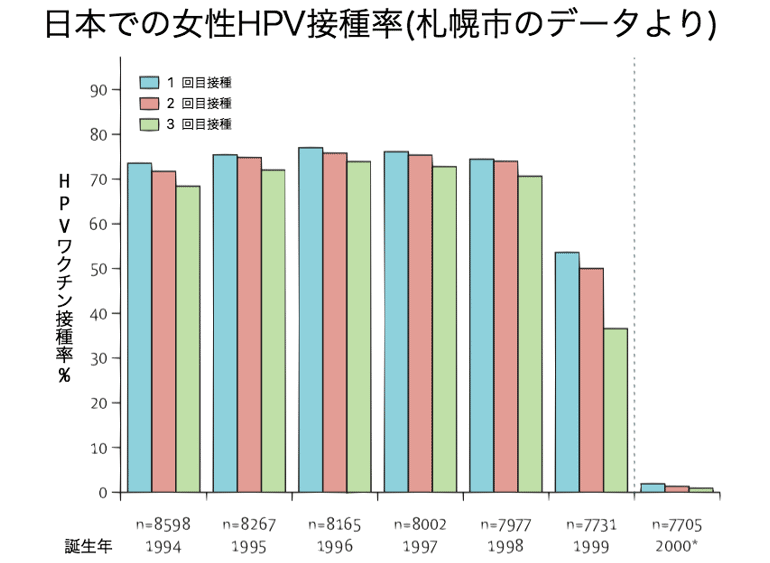
対象接種年齢の女子にHPVワクチンが接種され、1994-1998年生まれの女性では70%近くの接種率がありました13)。
2013年4月にHPVワクチンの定期接種(法律に基づいて市区町村が主体となってワクチン接種を実施すること)が開始されました。
しかし、わずか2ヶ月後の2013年6月14日にHPVワクチンの副反応が報告され厚生労働省は積極的な接種勧奨の一時差し控えを決定しました。
そしてHPVワクチンの副反応に関する報道が大々的に行われ、それ以降HPVワクチンの接種率は1%未満となってしまいました。
その後、科学的見地からHPVワクチンの安全性を検証する研究が各国から報告されましたが、未だにHPVワクチンの接種は進んでいないというのが日本の状況です。
4.HPVワクチンの副作用は?安全性についての証拠はある?
それでは、実際にはHPVワクチンの安全性はどうなのでしょうか。
現在も各国で複数の研究が進み、HPVワクチンの安全性について確認が進められています。
現時点でもかなりの数の報告がありますが、それらの一部を紹介していきます。
| Autoimmune, neurological, and venous thromboembolic adverse events after immunisation of adolescent girls with quadrivalent human papillomavirus vaccine in Denmark and Sweden14) |
| デンマークとスウェーデンにおける4価ワクチン(ガーダシル)の安全性を評価した研究です。997,585人の女性(10-17歳)を対象とした後ろ向きコホート研究です。2006年10月-2010年12月までに4価ワクチン接種を受け、接種後180日以内に発症した自己免疫疾患、静脈血栓症について、接種していない群と比較して、ワクチンの副反応を解析しています。そして、HPVワクチンの接種と、自己免疫疾患や静脈血栓症に関連性を裏付ける証拠は見出されなかったと結論付けています。 |
| Monitoring the safety of quadrivalent human papillomavirus vaccine: findings from the Vaccine Safety Datalink.15) |
| 2006年8月から2009年10月の間に7つの医療機関において、4価ワクチンを接種した9〜26歳の女性のワクチン接種後副反応を調べた研究です。600558回のワクチン接種が調査されました。この研究では、ワクチン接種よるギランバレー症候群、脳卒中、静脈血栓塞栓症、虫垂炎、アナフィラキシー、痙 攣、失神、アレルギー反応のリスク上昇に統計学的有意差はありませんでした。 |
| Quadrivalent HPV vaccination and risk of multiple sclerosis and other demyelinating diseases of the central nervous system.16) |
| デンマークとスウェーデンにおいて、10-44歳の女性400万人を対象に、4価ワクチン(ガーダシル )接種による多発性硬化症と、その他の脱髄疾患の関連を検証した研究です。接種後2年間の副反応リスクを調査しています。結果的に、HPVワクチン 接種による、多発性硬化症またはその他の脱髄疾患のリスク増加はなかったと結論されています。 |
| No Association between HPV Vaccine and Reported Post-Vaccination Symptoms in Japanese Young Women: Results of the Nagoya Study17) |
| 1994年4月2日から2001年4月1日に名古屋市で生まれた約7万人の女性を対象にアンケートを行った研究です。集計できたのは計2万9846人でした。24の症状について調査を行い、HPVワクチン接種群と非接種群を比較しました。各症状について、HPVワクチン接種群と非接種群の発症率に差がなかったと結論づけられています。 |
厚生労働省やWHOからもHPVワクチンの安全性について提言されています18,19)。
さらにはコクランレビューでも「重篤な有害事象の発現リスクは、HPVワクチン接種群と対照群(プラセボまたはHPV以外の感染症に対するワクチンを接種)とで同等であった。」とされ、ワクチンの安全性に関する研究は現在も続いています。
HPVワクチンまとめ
- HPVワクチンが子宮頸部前がん性病変を予防することを示す確実性の高いエビデンスが存在。
- HPVワクチンによって、重篤な有害事象生じるリスクは増大しない。
-参考文献-
(1) Munoz N, et al. Safety, immunogenicity, and efficacy of quadrivalent human papillomavirus (types 6, 11, 16, 18) recombinant vaccine in women aged 24-45 years: a randomised, double-blind trial. 2009 Jun 6;373(9679):1949-57
(2) Castellsague X et al. End-of-study safety, immunogenicity, and efficacy of quadrivalent HPV (types 6, 11, 16, 18) recombinant vaccine in adult women 24-45 years of age. Br J Cancer. 2011 Jun 28;105(1):28-37
(3) Huh WK, et al.Final efficacy, immunogenicity, and safety analyses of a nine-valent human papillomavirus vaccine in women aged 16-26 years: a randomised, double-blind trial. Lancet. 2017 Nov 11;390(10108):2143-2159
(4) Tabrizi SN, et al: Fall in human papillomavirus prevalence following a national vaccination program. J Infect Dis 2012;206: 1645-1651
(5) Tabrizi SN, et al: Assessment of herd immunity and cross-protection after a human papillomavirus vaccination programme in Australia: a repeat cross-sectional study. Lancet Infect Dis 2014; 14: 958-66
(6) Cameron RL, et a: Human papillomavirus prevalence and herd immunity after introduction of vaccination program, Scotland, 2009-2013. Emerg Infect Dis 2016; 22: 56-64.
(7) Berenson AB, et al: Change in human papillomavirus prevalence among U.S. women aged 18-59 years, 2009-2014. Obstet Gynecol 2017; 130: 693-701.
(8) Brotherton JM et al:HPV vaccine impact in Australian women: ready for an HPV‐based screening program. Med J Aust. 2016 ;204(5):184.
(9) Flagg EW et al: Ecological Association of Human Papillomavirus Vaccination with Cervical Dysplasia Prevalence in the United States, 2007–2014. Am J Public Health. 2016 December; 106(12): 2211–2218.
(10) Pollock KG, et al:Reduction of low- and high-grade cervical abnormalities associated with high uptake of the HPV bivalent vaccine in Scotland.Br J Cancer. 2014 Oct 28; 111(9): 1824–1830.
(11) Herweijer E et al:Quadrivalent HPV vaccine effectiveness against high-grade cervical lesions by age at vaccination: A population-based study.Int J Cancer. 2016 Jun 15;138(12):2867-74.
(12) Luostarinen T, et al: Vaccination protects against invasive HPV-associated cancers. Int J Cancer 2017 Dec 26. doi: 10.1002/ijc.31231.
(13) Hanley et al: HPV vaccination crisis in Japan.Lancet 385:2015
(14) Arnheim-Dahlström L, Pasternak B, Svanström H, Sparén P, Hviid A. Autoimmune, neurological, and venous thromboembolic adverse events after immunisation of adolescent girls with quadrivalent human papillomavirus vaccine in Denmark and Sweden: Cohort study. British Medical Journal 2013; 347:f5906.
(15) Gee J, Naleway A, Shui I, et al. Monitoring the safety of quadrivalent human papillomavirus vaccine: Findings from the Vaccine Safety Datalink. Vaccine 2011; 29(46):8279-8284.
(16) Sheller NM, et al: Quadrivalent HPV vaccination and risk of multiple sclerosis and other demyelinating diseases of the central nervous system. JAMA. 2015 Jan 6;313(1):54-61.
(17) Suzuki S et al: No association between HPV vaccine and reported post-vaccination symptoms in Japanese young women: Results of the Nagoya study.Papillomavirus Res. 2018 Jun;5:96-103. doi: 10.1016/j.pvr.2018.02.002. Epub 2018 Feb 23.
(18) https://www.mhlw.go.jp/stf/shingi2/0000208910_00006.html
(19) https://www.who.int/vaccine_safety/committee/topics/hpv/June_2017/en/
(20) https://www.cochrane.org/ja/CD009069/zi-gong-jing-ganoyobiqian-ganxing-bing-bian-noyu-fang-womu-de-tosuruhitopapiromauirusunidui-suruyu
GENTLEMAN PROJECT
Copyright © GENTLEMAN PROJECT All rights reserved.